Fer
Le fer est un élément chimique, de symbole Fe et de numéro atomique 26. C'est le métal de transition et le matériau ferromagnétique le plus courant dans la vie quotidienne, sous forme pure ou d'alliages.
Définitions :
- Le fer est un minéral essentiel à la croissance des plantes. Des plantes au feuillage jaune sont le signe d'une carence en fer, il est alors envisageable d'ajouter des produits du commerce. La teneur en fer doit être comprise entre 0.25 mg/l et 1.5 mg/l. (source : aquafish.free)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informations générales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, Symbole, Numéro | Fer, Fe, 26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Série chimique | Métaux de transition | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, Période, Bloc | 8, 4, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 7, 874 g·cm-3 (20 °C) [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté | 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Couleur | Blanc argenté ; reflets gris | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N° CAS | [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N° EINECS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse atomique | 55, 845 ± 0, 002 u [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique (calc) | 140 pm (156 pm) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de covalence | 1, 32 ± 0, 03 Å (low spin) [3] 1, 52 ± 0, 06 Å (high spin) [3] |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [Ar] 3d6 4s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électrons par niveau d'énergie | 2, 8, 14, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État (s) d'oxydation | +2, +3, +4, +6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxyde | Amphotère | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Structure cristalline | Cubique centré | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État ordinaire | Solide ferromagnétique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1 538 °C [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 2 861 °C [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de fusion | 13, 8 kJ·mol-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de vaporisation | 349, 6 kJ·mol-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molaire | 7, 09×10−6 m3·mol-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur | 7, 05 Pa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son | 4 910 m·s-1 à 20 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Divers | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité (Pauling) | 1, 83 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur massique | 440 J·kg-1·K-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité électrique | 9, 93×106 S·m-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 80, 2 W·m-1·K-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilité | sol. dans H2SO4 dilué[4], HCl [5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergies d'ionisation[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1re : 7, 9024 eV | 2e : 16, 1877 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3e : 30, 652 eV | 4e : 54, 8 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5e : 75, 0 eV | 6e : 99, 1 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7e : 124, 98 eV | 8e : 151, 06 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9e : 233, 6 eV | 10e : 262, 1 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11e : 290, 2 eV | 12e : 330, 8 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 13e : 361, 0 eV | 14e : 392, 2 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 15e : 457 eV | 16e : 489, 256 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 17e : 1 266 eV | 18e : 1 358 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 19e : 1 456 eV | 20e : 1 582 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 21e : 1 689 eV | 22e : 1 799 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 23e : 1 950 eV | 24e : 2 023 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 25e : 8 828 eV | 26e : 9 277, 69 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes les plus stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Produit non contrôlé | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI & CNTP, sauf indication contraire. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le fer est un élément chimique, de symbole Fe et de numéro atomique 26. C'est le métal de transition et le matériau ferromagnétique le plus courant dans la vie quotidienne, sous forme pure ou d'alliages. Le fer pur est un métal mou (davantage toujours que l'aluminium), mais l'adjonction de faibles quantités d'impuretés (quelques pourcents) le rend beaucoup plus dur : l'alliage avec d'autres éléments métalliques ou du carbone apporte des aciers qui peuvent être mille fois plus durs que le fer pur.
Le fer 56 est le nucléide stable le plus lourd issu de la combustion du silicium par réactions α lors de la nucléosynthèse stellaire, qui aboutit en fait au nickel 56, lequel est instable et donne du 56Fe par deux désintégrations β+ successives ; les éléments de numéro atomique plus élevé sont synthétisés par des réactions plus énergétiques intervenant plutôt lors de l'explosion de supernovæ. Le fer est ainsi l'élément le plus abondant au cœur des étoiles géantes rouges ; c'est aussi le métal le plus abondant dans les météorites mais aussi dans le noyau des planètes, comme celui de la Terre.
Histoire de la métallurgie du fer
Le fer était connu dès le chalcolithique à travers les météorites ferreuses, et sa métallurgie demeura particulièrement confidentielle jusqu'au XIIe siècle av. J. -C. , époque qui marque, exactement, le début de «l'Âge du fer» : les Hittites, en Anatolie, avaient développé une assez bonne maîtrise du travail du fer autour du XVe siècle av. J. -C. , dont leur tradition attribuait l'origine dans la région du Caucase, et cette technique semble aussi avoir été connue assez tôt en Inde du nord, surtout dans l'Uttar Pradesh. Jusqu'au Moyen Âge, l'Europe raffina le fer au moyen de bas fourneaux, qui ne produisent pas de fonte ; la technique du haut fourneau, qui, elle , produit de la fonte brute à partir de charbon de bois et de minerai de fer, a été mise au point en Chine au milieu du Ve siècle av. J. -C. et a par conséquent mis plus d'un millier d'années à diffuser jusqu'en Occident.
Propriétés
Propriétés physiques
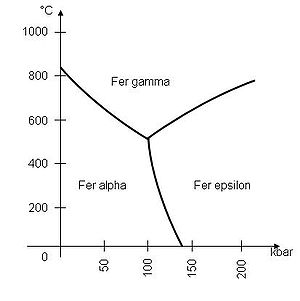
C'est un métal qui, selon la température, se présente sous plusieurs formes allotropiques :
- Dans les conditions normales de pression et de température, c'est un solide cristallin de structure cubique centré (fer α ou ferrite).
- À partir de 912 °C, il devient cubique à faces centrées (fer γ ou austénite).
- Au-delà de 1 394 °C, il redevient cubique centré (fer δ).
- Il fond à 1 535 °C.
- La transformation en fer ε (structure hexagonale compacte) ne se rencontre qu'à des pressions supérieures à 110 kilobars.
Sa capacité calorifique est de 0, 5 kJ/kg/°C.
Le fer est ferromagnétique : les moments magnétiques des atomes s'alignent sous l'influence d'un champ magnétique extérieur et conservent leur nouvelle orientation après la disparition de ce champ.
Des courants de convection dans la couche externe du noyau terrestre (noyau externe), de «l'alliage» liquide essentiellement fer-nickel, sont supposés être à l'origine du champ magnétique terrestre.
S'il est exposé à l'air libre ou mis dans l'eau salée, il rouille et s'il n'est pas entretenu, il va progressivement se dégrader jusqu'à ce que plus rien ne reste de son état solide naturel.
Il a une dureté entre 4 et 5 sur l'échelle de mohs.
Propriétés chimiques

Le fer, combiné à l'oxygène, forme trois oxydes : FeO (oxyde ferreux), Fe2O3 (oxyde ferrique), Fe3O4 (oxyde magnétique).
A l'air libre en présence d'humidité, il se corrode en formant de la rouille Fe2O3, n (H2O). La rouille étant un matériau poreux, la réaction d'oxydation peut se propager jusqu'au cœur du métal, contrairement, par exemple, à l'aluminium, qui forme une couche fine d'oxyde imperméable.
En solution, il présente deux valences principales :
- Fe2+ (le fer ferreux) qui présente une faible couleur verte ;
- Fe3+ (le fer ferrique) qui possède une couleur rouille caractéristique. Fe3+ peut être réduit par du cuivre métallique, par exemple, réaction à l'origine du procédé de gravure des circuits imprimés par le trichlorure de fer, FeCl3.
L'hémoglobine du sang, qui permet aux globules rouges de transporter le dioxygène, contient du fer.
Propriétés nucléaires
Le noyau de fer 56 possède la masse par nucléon la plus faible de l'ensemble des nucléides mais pas l'énergie de liaison la plus élevée, en raison d'une proportion de protons légèrement plus élevée que le nickel 62 qui, lui, a l'énergie de liaison la plus élevée par nucléon[8].
Le fer 56 résulte de la désintégration naturelle du nickel 56, isotope instable produit au cœur d'étoiles massives par fusion du silicium 28 au cours de réactions alpha en cascade qui s'arrêtent au nickel exactement parce que ce dernier possède l'énergie de liaison nucléaire par nucléon la plus élevée : poursuivre la fusion, pour produire par exemple du zinc 60, consommerait de l'énergie au lieu d'en libérer.
Occurrence et gisements
Le fer est le 6e élément le plus abondant dans l'Univers, il est constitué comme «élément final» de fusion nucléaire, par fusion du silicium dans les étoiles massives. Tandis qu'il compose à peu près 5 % (en masse) de la croûte terrestre, le noyau terrestre est censé être en grande partie un alliage de fer-nickel, constituant ainsi 35 % de la masse de la Terre dans son ensemble ! Le fer est peut-être, en fait, l'élément le plus abondant sur Terre ou du moins identique (en juste 2e position) en masse à l'oxygène, mais uniquement le 4e le plus abondant dans la croûte terrestre.

La majeure partie du fer dans la croûte est combinée avec l'oxygène, formant des minerais d'oxyde de fer, tels que l'hématite (Fe2O3), la magnétite (Fe3O4) et la limonite (Fe2O3. nH2O).
L'oxyde magnétique ou magnétite Fe3O4 est connu depuis l'Antiquité grecque. Il tire son nom du mont Magnetos (le grand mont), une montagne grecque spécifiquement riche en ce minéral.
Environ 1 météorite sur 20 comprennent de la tænite unique alliage de minéral de fer-nickel (fer 35-80 %) et la kamacite (fer 90-95 %). Quoique rares, les météorites de fer sont la forme principale de fer natif (métallique) sur la surface terrestre.
La couleur rouge de la surface de Mars est due à un régolithe riche en oxyde de fer. la «planète rouge» est en quelque sorte une «planète rouillée».
Métallurgie
Extraction
Le fer s'obtient industriellement en réduisant par le monoxyde de carbone (CO) provenant du carbone, les oxydes de fer contenus dans le minerai ; ceci peut être réalisé :
Depuis l'Âge du fer et jusqu'au XIXe siècle dans certaines régions du monde : par réduction du minerai avec du charbon de bois dans un bas fourneau ou bas-foyer : on obtient, sans passer par une phase liquide, une masse hétérogène de fer et d'acier nommée «loupe», «massiot» ou «éponge de fer». Cette masse de métal brute se forme en incorporant plus ou moins de scories (déchet minéral de la réduction) et de porosités. Pour rendre le métal propre à l'élaboration d'objets, la «loupe» peut être brisée et triée par type de teneur en carbone ou plus simplement être directement compactée à la forge. Ce travail, dit d'épuration, fluctue suivant les régions et des cultures techniques. Globalement, son principe consiste à évacuer la scorie ainsi qu'à souder les différentes parties de la masse de métal. On parle de cinglage pour l'étape consistant à marteler le métal à chaud pour évacuer la scorie et de corroyage pour désigner la fin de l'opération d'épuration, consistant à réaliser plusieurs passes à la forge en repliant et en soudant le métal sur lui-même.
C'est avec le développement des moulins et de la force hydraulique, que la lignée technique du haut-fourneau a pu se développer et s'est globalement imposée sur celle du bas-fourneau. La principale différence dans ce procédé est que la réduction des oxydes de fer se fait en même temps que la fusion. Le métal est produit en phase liquide, formant la fonte.
C'est en ajoutant de la silice au minerai à gangue calcaire, ou du calcaire au minerai à gangue siliceuse, qu'on est passé au haut fourneau : une proportion précise de silice et de calcaire donne un laitier fusible qui se sépare naturellement de la fonte liquide. L'absorption de carbone par le fer donne de la fonte liquide, dont sa température de fusion est au moins 200 °C plus basse que le fer.
Pendant longtemps les haut fourneaux ont fonctionné au charbon de bois. Le coke plus dur a permis de faire des hauts fourneaux bien plus hauts mais produisant une fonte chargée en soufre.
Pour obtenir un métal forgeable, il faut affiner la fonte. Cette étape, réalisée dans une aciérie consiste principalement à décarburer la fonte pour obtenir un alliage plus faible en carbone : fer ou acier. La fonte est transformée en acier au convertisseur. Dans cette cuve, on souffle de l'oxygène sur la fonte pour en éliminer le carbone.
Si l'élimination du carbone par combustion avec l'oxygène est l'étape principale dans l'affinage de la fonte, l'aciérie va aussi :
- éliminer le soufre venant du coke chargé dans le haut-fourneau. En injectant du carbure de calcium, du magnésium et/ou de la soude, le soufre va former des oxydes qui vont flotter vers le laitier de la fonte. Ce laitier sera alors retiré avec un racloir.
- brûler le silicium dissous dans la fonte. Cette combustion est la première réaction chimique qui se produit dans un convertisseur. Elle est suivie immédiatement par la combustion du carbone.
- éliminer le phosphore venant du minerai. Comme le soufre, cet autre élément fragilisant, on procède par réaction avec de la chaux dans le convertisseur, pour former du P2O5 qui, en allant dans le laitier, sera éliminé par séparation d'avec le fer liquide. La réaction de déphosphoration est la troisième et dernière réaction chimique recherchée dans le convertisseur
Le fer et ses alliages

la fonte et l'acier (1.000 Mt) sont les principaux alliages :
- la fonte contient de 2, 1 % à 6, 67 % de carbone ;
- l'acier contient de 0, 025 % à 2, 1 % de carbone ;
- en dessous de 0, 025 % de carbone, on parle de fers industriels.
L'ajout de divers éléments d'additions permet d'obtenir des fontes et des aciers spéciaux, maisd l'élément ayant la plus forte incidence sur les propriétés de ces alliages reste le carbone.
Les aciers inoxydables doivent leurs propriétés de résistance à la corrosion par l'apport de chrome.
D'autres alliages ont été mis au point à des fins civiles ou militaires comme, par exemple, les ferro-manganèses, les ferro-nickels, le ferro-chromes, les intermétalliques Fe-Al ou encore les Fe-Cr-Al.
Industrie de l'extraction de minerais de fer
Les principaux producteurs de minerais de fer dans le monde sont , en 2008[9] :
- BHP Billiton et Rio Tinto (39, 6 % du marché mondial estimé en 2008, en cas de fusion)
- Vale (ex-CVRD) (Brésil) (35, 7 %)
- Rio Tinto (24 % seul)
- BHP Billiton (16 % seul)
- Fortescue (5, 4 %)
- Kumba (5, 2 %)
- Autres (LKAB, SNIM, CVG Ferrominera, Hierro Peru, Kudremukh, CAP) (13, 7%)
En 2007, la Chine produit un tiers de l'acier mondial et attire 50 % des exportations du minerai de fer[10].
Utilisation
Le fer n'est quasiment pas utilisé à l'état pur (il est utilisé à l'état pur pour résoudre certains problèmes de soudabilité, surtout sur aciers inoxydables).
C'est le principal élément entrant dans la composition de l'acier.
L'appellation "fil de fer" ne veut dire en rien fil en fer pur, les fils de fer sont en fait fabriqués en acier doux, particulièrement malléable.
Le fer métallique et ses oxydes sont utilisés depuis des décennies pour fixer des informations analogiques ou numériques sur des supports appropriés (bandes magnétiques, cassettes audio et vidéo, disquettes). L'usage de ces matériaux est cependant désormais supplanté par des composés possédant une meilleure permittivité, par exemple dans les disques durs.
Dans l'alimentation
Le fer est un oligo élément et fait partie des sels minéraux indispensables qu'on retrouve dans les aliments, mais peut être toxique sous certaines formes. Une carence en fer est source d'anémie et peut affecter le développement cognitif et socio-émotionionnel du cerveau de l'enfant [11] ou exacerber les effets de certaines intoxications (saturnisme par exemple).
Le fer est essentiel au transport de l'oxygène ainsi qu'à la formation des globules rouges dans le sang. Il est un constituant essentiel des mitochondries, dans la mesure où il entre dans la composition du hème du cytochrome C. Il joue aussi un rôle dans la fabrication de nouvelles cellules, d'hormones et de neurotransmetteurs. Le fer contenu dans les végétaux (fer dit «non héminique») Fe3+ ou fer ferrique est moins bien absorbé par l'organisme que celui contenu dans les aliments crus d'origine animale (fer «héminique») Fe2+ ou fer ferreux. La cuisson des viandes transforme une partie du fer héminique en fer non héminique, moins biodisponible. Cependant, l'absorption du fer est favorisée si on le consomme avec certains nutriments, comme la vitamine C ou le jus de citron. Mettre du jus de citron sur ses aliments est par conséquent une excellente habitude culinaire si on manque de fer ; par contre, un complément en vitamine C est inutile si on ne souffre pas de carence en vitamine C (la carence extrême est le scorbut), même si cela ne peut pas mener à une hypervitaminose puisque la Vitamine C est hydrosoluble (et par conséquent son surplus s'élimine par la sudation, la voie urinaire).
En revanche son absorption est inhibée par la consommation de thé et/ou de café[12] car les tanins (polyphénols) sont des chélateurs de fer. Les buveurs de thé en particulièrement grande quantité ont par conséquent quelquefois des anémies ferriprives[13].
L'accumulation de fer dans l'organisme entraîne la mort cellulaire. Des chercheurs de l'Inserm suspectent, à cause de cela, que l'excès de fer pourrait être impliqué dans la dégénérescence des neurones chez les patients atteints de la maladie de Parkinson[14].
En pharmacie
Le fer est utilisé pour la préparation de médicaments. Du XVIIe siècle au début du XXe siècle, il était l'un des principaux composants des boules d'acier vulnéraires, boules de Nancy, boules de Molsheim, boules minérales des Chartreux, qu'on faisait tremper dans de l'eau pour la charger en substances connues bénéfiques[15].
Symbolique
- Le fer est l'attribut de Mars, dieu romain de la guerre.
- Le fer symbolise la solidité (ex. : Le pot de terre et le pot de fer, la fable de Jean de La Fontaine).
- Dans la mythologie le fer symbolise la corruption ou la déchéance, par opposition à l'or, métal plus noble. Le mythe des races, d'Hésiode, où le dernier et le pire de l'ensemble des âges est l'âge de fer, forme une des illustrations de cette valeur symbolique du fer dans les récits mythologiques.
- Les noces de fer symbolisent les 41 ans de mariage dans le folklore français.
- Dans le calendrier républicain français, le jour du fer était le plus souvent le 12 janvier, 23ème jour du mois de nivôse[réf. nécessaire].
Notes et références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd. , Relié, 2804 p. (ISBN 978-1-420-09084-0)
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, «Covalent radii revisited», dans Dalton Transactions, 2008, p. 2832 - 2838 [ lien DOI ]
- (en) Metals handbook, vol. 10 : Materials characterization, ASM International, 1986, 1310 p. (ISBN 0-87170-007-7) , p. 343
- (en) Thomas R. Dulski, A manual for the chemical analysis of metals, vol. 25, ASTM International, 1996, 251 p. (ISBN 0803120664) [lire en ligne], p. 71
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, TF-CRC, 2006, 87e éd. (ISBN 0849304873) , p. 10-202
- «Fer» dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) The Most Tightly Bound Nuclei Les nucléides les plus solidement liés.
- Bernstein Resærch, in Les Echos du 5 février 2008, page 35
- Alain Faujas, «Le minerai de fer augmentera d'au moins 65 % en 2008», dans Le Monde du 20-02-2008, mis en ligne le 19-02-2008, [lire en ligne]
- Iron Deficiency Anemia and Cognitive Function in Infancy R. Colin Carter, Joseph L. Jacobson, Matthew J. Burden, Rinat Armony-Sivan, Neil C. Dodge, Mary Lu Angelilli, Betsy Lozoff, and Sandra W. Jacobson Pediatrics 2010; 126 : e427-e434. Abstract
- voir par exemple la notice du Ferrostrane (férédétate de sodium) de Teofarma ou du Timoferol (vitamine C + Fe) d'Elerte
- http ://www. passeportsante. net/fr/Maux/Problemes/Fiche. aspx?doc=anemie_ferriprive_pm#P88_7104
- Communiqué du 28 octobre 2008 en ligne
- (fr) Ordre des pharmaciens – 15 mars 2002 Colette Keller-Didier «Les boules d'acier vulnéraires, dites boules de Nancy.»
Voir aussi
Lien externe
- Dossier sur le fer : Le fer tombe le masque, Futura-sciences
| s1 | s2 | g | f1 | f2 | f3 | f4 | f5 | f6 | f7 | f8 | f9 | f10 | f11 | f12 | f13 | f14 | d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | d9 | d10 | p1 | p2 | p3 | p4 | p5 | p6 | |
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo | |
| 8 | Uue | Ubn | * | Ute | Uqn | Uqu | Uqb | Uqt | Uqq | Uqp | Uqh | Uqs | Uqo | Uqe | Upn | Upu | Upb | Upt | Upq | Upp | Uph | Ups | Upo | Upe | Uhn | Uhu | Uhb | Uht | Uhq | Uhp | Uhh | Uhs | Uho |
| ↓ | |||||||||||||||||||||||||||||||||
| g1 | g2 | g3 | g4 | g5 | g6 | g7 | g8 | g9 | g10 | g11 | g12 | g13 | g14 | g15 | g16 | g17 | g18 | ||||||||||||||||
| * | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs | Ubo | Ube | Utn | Utu | Utb | Utt | Utq | Utp | Uth | Uts | Uto | |||||||||||||||
| Métalloïdes | Non-métaux | Halogènes | Gaz rares |
| Métaux alcalins | Métaux alcalino-terreux | Métaux de transition | Métaux pauvres |
| Lanthanides | Actinides | Superactinides | Éléments non classés |
Recherche sur Google Images : |
|
"Fer, fonte, acier, ne pas" L'image ci-contre est extraite du site rohr.fr Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (211 × 210 - 15 ko - jpg)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 09/12/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.




 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité