Cryolithe
La cryolithe, ou cryolite, est une espèce minérale composée de fluorure double de sodium et d'aluminium, de formule Na 3 AlF 6 aussi noté 3NaF, AlF 3.

Catégories :
Composé de l'aluminium - Composé du sodium - Produit chimique toxique - Produit chimique dangereux pour l'environnement - Halogénure (minéral) - Minéral - Fluorure - Sodium (minéral) - Aluminium (minéral) - Lithos
Recherche sur Google Images :

Source image : manmonster.centerblog.net Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- La cryolithe est essentiellement utilisée pour la production d'aluminium et ... La production mondiale (avec le fluorure d'aluminium AlF 3) est de plus de 400... (source : dictionnaire.sensagent)
- La cryolithe, ou cryolite, est un minéral composé de fluorure double de sodium et d'aluminium, de formule NaAlF aussi noté 3NaF, AlF. La cryolithe est ... (source : 7fr)
- La cryolithe est un minéral composé de fluorure double de sodium et d'aluminium, de formule Na3 AlF 6. Ce minéral fond à 1 000 °C. On utilise la cryolithe... (source : lachimie)
| Cryolithe | |||
|---|---|---|---|
| Général | |||
| Nom IUPAC | hexafluoroaluminate de trisodium | ||
| No CAS | |||
| No EINECS | |||
| Propriétés chimiques | |||
| Formule brute | Na3AlF6 ou 3NaF, AlF3 | ||
| Masse molaire[1] | 209, 9412656 ± 3, 9E-6 g·mol-1 Al 12, 85 %, F 54, 3 %, Na 32, 85 %, |
||
| Précautions | |||
|
|
|||
|
|||
|
|
|||
| Phrases R : 20/22, 48/23/25, 51/53, | |||
| Phrases S : (1/2), 22, 37, 45, 61, | |||
|
|
|||
|
|||
|
|
|||
 |
|||
|
|
|||
  Danger |
|||
|
CatégorieIV : halogénures |
|||
|
|
|||
|
|
|||
| Couleur | incolore, blanche, grise, brun rougeâtre à brun-noir |
||
| Système cristallin | monoclinique | ||
| Fracture | irrégulière | ||
| Échelle de Mohs | 2, 5 - 3 [4] | ||
| Éclat | vitreux | ||
|
|
|||
| Indice de réfraction | α=1, 3385-1, 339 β=1, 3389-1, 339 γ=1, 3396-1, 34 | ||
| Biréfringence | Δ=0, 0010-0, 0011 ; biaxe positif | ||
| Trait | blanc | ||
| Transparence | transparent à translucide | ||
|
|
|||
| Densité | 2, 95 g·cm-3 [4] | ||
| Température de fusion | 960-1027°C [4] °C | ||
| Solubilité | Soluble dans H2SO4 concentré chaud (dégage du F2) [5]; 0, 4 g à 20 °C |
||
|
|
|||
| Radioactivité | aucune | ||
|
|
|||
La cryolithe, ou cryolite, est une espèce minérale composée de fluorure double de sodium et d'aluminium, de formule Na3AlF6 aussi noté 3NaF, AlF3.
La cryolithe est essentiellement utilisée pour la production d'aluminium et dans l'industrie des céramiques. Elle a été découverte sur la côte ouest du Grœnland. C'est un minéral rare ; aussi, pour faire face aux besoins de l'industrie, la cryolithe est produite artificiellement.
Découverte
À la fin du XVIIIe siècle, un cargo de la Compagnie royale du commerce grœnlandais ramène du Grœnland des échantillons de divers minerais à Copenhague. Le premier échantillon de cryolithe est étudié et décrit par Heinrich Christian Friedrich Schumacher en 1795 (professeur de médecine, botaniste et minéralogiste à l'Académie royale de chirurgie).
Il a été étudié par le brésilo-portugais Jozé Bonifacius de Andrada et le danois Peter Christian Abildgaard. De Andrada rapporta que la cryolithe avait un aspect transparent et brillant et qu'elle avait la propriété de fondre sous l'action d'une flamme comme la glace. Il l'appela cryolithe ce qui veut dire «pierre gelée» en grec (κρύος «froid», λίθος «pierre»). Les habitants du Grœnland l'appelaient orsukksiksæt. Abildgaard fit une communication à l'Académie danoise des sciences en 1800.
L'analyse chimique de la cryolithe a été faite de manière indépendante par Martin Heinrich Klaproth à Berlin et Louis-Nicolas Vauquelin à Paris.
Après avoir exploré le Grœnland, l'allemand Karl Ludwig Giesecke, employé par la Compagnie royale du commerce grœnlandais, montra en 1820 que la cryolithe n'était que peu présente. L'unique gisement connu se situe dans la baie de Arsuk près de la ville nommée Ivittuut. La mine qui exploitait ce gisement a fermé en 1987.
Utilisation
L'aluminium
La cryolithe est essentiellement utilisée comme fondant dans la production d'aluminium. Elle est mélangée à l'alumine extraite de la bauxite. Le mélange est fondu aux environs de 950 °C et ensuite électrolysé.
Elle a été choisie parce qu'elle dissout les fluorures et les oxydes (dont l'alumine) mais pas l'aluminium, elle conduit le courant électrique et elle fond à 1 000 °C.
Le verre et la céramique
Pour la fabrication des verres, la cryolithe est utilisée comme fondant et opacifiant. De même, elle abaisse la viscosité du verre en fusion, facilitant ainsi la suppression des bulles.
Comme dans le cas de l'alumine, c'est grâce à son pouvoir de dissolution des oxydes (SiO2, CaO par exemple) qu'elle abaisse la température de fusion de ces oxydes en formant des eutectiques. Son pouvoir opacifiant est utilisé pour augmenter l'opalescence (couleur de l'opale, pierre semi-précieuse de couleur blanche nacrée à reflet de nacre) de certains verres.
Elle entre dans la composition de certains émaux blancs dans des proportions allant de 5 à 15 % en masse. Elle aide à donner un aspect glacé par l'apport de fluorure.
Cryolithe artificielle
L'unique gisement de cryolithe ne peut apporter les besoins industriels.
Elle est fabriquée par diverses techniques reposant sur le mélange de : acide fluorhydrique (HF), fluorure de sodium (NaF), fluorure d'ammonium, acide fluosilicique, acide fluoborique, hydroxyde d'aluminium, sulfate d'aluminium, aluminate de sodium, soude (NaOH), carbonate de sodium, chlorure de sodium (NaCl), sulfate de sodium.
Dans les applications industrielles, elle se présente le plus fréquemment sous forme de poudre blanche.
La production mondiale (avec le fluorure d'aluminium AlF3) est de plus de 400 000 tonnes par an.
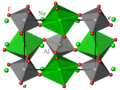
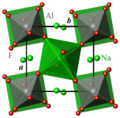
Cristallographie
À température ambiante, la cryolithe cristallise dans le groupe d'espace monoclinique P21/n (Z = 2) [6].
- Paramètres de la maille conventionnelle : a = 5, 402 Å, b = 5, 596 Å, c = 7, 756 Å, β = 90, 28° ; V = 234, 5 Å3
- Densité calculée = 2, 97 g/cm3
Les cations Al3+ sont en coordination octaédrique un peu déformée d'anions F–.
Les cations Na+ occupent deux sites non-équivalents, Na1 et Na2 :
- Na1 est en coordination octaédrique un peu déformée de F– ;
- Na2 a pour voisins 8 anions F–.
Les octaèdres AlF6 et Na1F6 sont reliés dans les trois directions de l'espace par leurs sommets. La structure de la cryolithe est dérivée de la structure pérovskite ABX3, avec un site A occupé par Na2 et un site B partagé de façon alternée entre Na1 et Al. La différence de taille entre les octaèdres AlF6 et Na1F6 (longueurs de liaison moyennes
À 565 °C, la cryolite subit une transition de phase structurelle et devient cubique[7], de groupe d'espace Fm3m (Z = 4) avec a = 8, 023 Å, V = 516, 5 Å3 et de densité calculée 2, 7 g/cm3 à 800 °C[8]. Les sites de fluor deviennent désordonnés et sont occupés à 25 % autour des axes quaternaires de rotation, indiquant des fluctuations spatiales et temporelles des atomes. Ces fluctuations d'origine thermique permettent de compenser localement les problèmes créés par la différence de taille entre les octaèdres AlF6 et Na1F6.
Bibliographie
Pour la partie historique :
- Helge Kragh (Institut des sciences exactes, Université Aarhus) in From curiosity to industry, the early history of cryolite soda manufacture, Cahier d'histoire de l'aluminium, n°18, été 1996.
Références
- Masse molaire calculée selon Atomic weights of the elements 2007 sur www. chem. qmul. ac. uk
- «Fluorure double d'aluminium et de sodium» dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- «Aluminium sodium fluoride» dans la base de données Hazardous Substances Data Bank, consulté le 14 août 2010
- (en) Thomas R. Dulski, A manual for the chemical analysis of metals, vol. 25, ASTM International, 1996, 251 p. (ISBN 0803120664) [lire en ligne], p. 71
- ICSD No. 4 029 ; (en) F. C. Hawthorne et R. B. Ferguson, «Refinement of the crystal structure of cryolite», dans The Canadian Mineralogist, vol. 13, no 4, 1975, p. 377-382
- (en) Qingdi Zhou et Brendan J. Kennedy, «High-temperature powder synchrotron diffraction studies of synthetic cryolite Na3AlF6», dans Journal of Solid State Chemistry, vol. 177, no 3, 2004, p. 654-659 [ lien DOI ]
- ICSD No. 164 688 ; (en) Ľ. Smrčok, M. Kucharík, M. Tovar et I. Žižak, «High temperature powder diffraction and solid state DFT study of β-cryolite (Na3AlF6) », dans Crystal Research and Technology , vol. 44, no 8, 2009, p. 834-840 [ lien DOI ]
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 09/12/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.






 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité